服務熱線
13764793648
測鈣的含量——高錳酸鉀法
一、注意事項
1、 過濾時,盡量將沉淀留在器皿中,否則沉淀移到濾紙上會把濾孔堵塞,影響過濾速度。
2、 KMnO4標準溶液不穩定,使用時注意濃度變化。
3、 本實驗過程長、繁,為使測定結果準確,幾份(一般是2~3份)沉淀的制作、過濾、洗滌及測定,都應在相同條件下平行操作。
二、實驗用品
濃H2SO4 ,30% H2O2,1:1氨水,⒋5% (NH4)2 C2O4溶液,0.1% (NH4)2 C2O4溶液,10% H2SO4溶液,甲基橙指示劑, c(1/5KMnO4)= 0.1 mol•L-1 KMnO4 標準溶液,10% BaCl2溶液,樣品。
三、操作步驟
1、 樣品預處理
樣品預處理常用消化法和灰化法兩種。凡樣品中含鈣量高時用消化法為宜;含鈣量低時用灰化法為宜。兩種方法制備的溶液均可測定鈣、磷、錳等元素。 本實驗只對消化法做一介紹:
準確稱取風飼料樣品2g左右,放入250mL凱氏瓶底部, 加入濃H2SO416mL,混勻潤濕后慢慢加熱至開始冒大量白煙,微沸約5分鐘,取下冷卻(約半分鐘),逐滴加入30 % H2O2約1 mL,繼續加熱微沸2~5分鐘,取下稍冷后,添加幾滴H2O2,再加熱煮幾分鐘,稍冷。必要時再加少量 H2O2(用量逐次減少)消煮,直到消煮液*清亮為止。zui后要微沸5分鐘,以除盡H2O2,冷卻后轉移到250mL容量瓶中,用蒸餾水多次沖洗凱氏瓶,一并放入容量瓶中,在室溫下定容。放置澄清后使用。
2、 草酸鈣的沉淀
用吸移管準確吸取上述處理過的溶液25.00mL(吸取的體積取決于樣品中鈣的含量,一般以消耗 c(1/5KMnO4)= 0.1 mol•L-1 KMnO4 標準溶液 25mL左右為宜),放入250mL燒杯中,加水稀至50 mL,沿玻棒加5% (NH4)2C2O4溶液20 mL,加熱到(75~85)℃(用手觸及燒杯,覺得燙)。再加入甲基橙指示劑2~3滴,在不斷攪拌下,逐滴加入1:1氨水至溶液由紅色變為黃色,再過量數滴。檢查沉淀是否*。如沉淀不*,繼續加入 (NH4)2C2O4溶液,至沉淀*。繼續加熱30分鐘或放置過夜以陳化沉淀使之形成Ca2C2O4粗晶形沉淀。
3、 沉淀的洗滌
用傾注法過濾及洗滌沉淀,先把沉淀與溶液放置一段時間,再將上層清液傾入漏斗中,讓沉淀盡可能地留在燒杯內,以免沉淀堵塞濾紙小孔,清液傾注完畢后進行沉淀的洗滌。沉淀先用0.1% (NH4)2C2O4溶液洗滌三次(每次用洗滌劑10~15 mL,用玻棒在燒杯中充分攪動沉淀,放置澄清,再傾瀉過濾),再用微熱的蒸餾水洗至無C2O42-(用10% BaCl2溶液檢查濾液)為止。
4 、測定
將帶有沉淀的燒杯放在上述過濾時用的漏斗下面,從漏斗上取下帶有沉淀的濾紙放在燒杯中,并用少量10% H2SO4沖洗漏斗,洗滌液也收在燒杯中。加入10% H2SO4 50mL使Ca2C2O4沉淀溶解,將溶液稀釋至約100mL,加熱溶液到(75~85)℃,用KMnO4標準溶液滴定至溶液呈微紅,30秒鐘內不褪色為終點。記錄消耗KMnO4的體積V1。
5 、空白試驗
另取濾紙一張,放入250 mL燒杯中,加入10% H2SO4溶液(其用量與溶解Ca2C2O4時相同體積),稀釋至100mL,加熱溶液到(75~85)℃,用KMnO4標準溶液滴定至微紅色,30秒鐘內不褪色為終點,記錄消耗KMnO4的體積V2。
6 、計算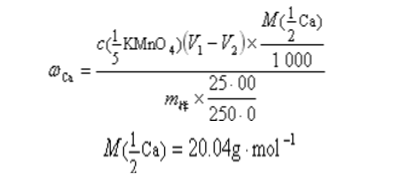
式中m為風干飼料樣品質量(單位:g)
四、 原理
利用KMnO4法測定鈣的含量,只能采用間接法測定。將樣品用酸處理成溶液,使Ca2+溶解在溶液中。Ca2+在一定條件下與C2O42-作用,形成白色CaC2O4沉淀。過濾洗滌后再將CaC2O4沉淀溶于熱的稀H2SO4中。用KMnO4標準溶液滴定與Ca2+ 1:1結合的C2O42-含量。其反應式如下:
Ca2++C2O42- = CaC2O4↓
CaC2O4+2H+ = 2Ca2++H2C2O4
5H2C2O4+2MnO4-+6H+ = 2Mn2++10CO2↑+8H2O
沉淀Ca2+時,為了得到易于過濾和洗滌的粗晶形沉淀,必須很好地控制沉淀的條件。通常是在含Ca2+的酸性溶液中加入足夠使Ca2+沉淀*的(NH4)2C2O4沉淀劑。由于酸性溶液中C2O42-大部分是以H C2O4-形式存在,這樣會影響CaC2O4的生成。所以在加入沉淀劑后必須慢慢滴加氨水,使溶液中H+逐漸被中和,C2O42-濃度緩慢地增加,這樣就易得到CaC2O4粗晶形沉淀。沉淀完畢,溶液pH值還在3.5~4.5,即可防止其他難溶性鈣鹽的生成,又不致使CaC2O4溶解度太大。加熱半小時使沉淀陳化(陳化的過程中小顆粒晶體溶解,大顆粒晶體長大)。過濾后,沉淀表面吸附的C2O42-必須洗凈,否則分析結果偏高。為了減少CaC2O4在洗滌時的損失,則先用稀(NH4)2C2O4溶液洗滌,然后再用微熱的蒸餾水洗到不含C2O42-時為止。將洗凈的CaC2O4沉淀溶解于稀H2SO4中,加熱至(75~85)℃,用KMnO4標準溶液滴定。